Цинк
| Физические свойства цинка Положение цинка в периодической системе элементов Металлохимические свойства цинка Термодинамические свойства цинка | Электрохимические и химические свойства цинка |
| | |
В целом разделение цинка на группы по назначению (литейные, деформируемые, антифрикционные, протекторные, припои) и хим-составу (системы цинк-медь, цинк-алюминий, цинк-магний) достаточно условно, поскольку некоторые сплавы используются и для литья, выдавливания и как антифрикционный материал, а также содержат по составу и алюминий и медь и магний.
Физические свойства цинка
Цинк - голубовато-серебристый блестящий металл; на воздухе быстро окисляется, покрываясь тонкой защитной пленкой, уменьшающей его блеск; имеет низкую температуру плавления. Объем металла при плавлении увеличивается в соответствии со снижением плотности. С повышением температуры уменьшается кинетическая вязкость и электропроводность цинка и возрастает его удельное электрическое сопротивление. Наиболее общие и важные физические характеристики цинка представлены ниже:
| Атомная масса: 65,37 Атомный объем: 9,15 Радиусы, нм: ионный (Zn2+) = 7,2-8,4; ковалентный = 12,5-12,7; металлический = 13,7-13,9 Сигония: Гекс Параметры решетки, нм: а = 26,645; с = 49,451; с/а = 1,856 Плотность цинка: 7,14 г/см3 Температура, К: плавления = 692,5; кипения = 1186 | Поверхностное натяжение жидкого цинка при (Тпл), н/м: 0,8 Поверхностная энергия, мДж/м2: 105 Удельное электрическое сопротивление р при 293К, Ом*м: 59,2*10-9 Удельная электропроводность, См/м: 16,5*10-6 Работа выхода электронов, эВ: 4,24 |
Положение цинка в периодической системе элементов
В настоящее время практически во всех промышленно развитых странах ощущается большой дефицит в цветных металлах. Поэтому необходим научно обоснованный подход к выбору и рациональному применению металлов, в том числе цинка и его соединений.
Наиболее общее представление о свойствах цинка и возможных изменениях этих свойств дает открытый Д.И.Менделеевым фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов. Согласно этому закону свойства элементов и металлов в частности определяются электронной структурой атомов. Именно величиной заряда ядер атомов обусловлено место, занимаемое каждым металлом в периодической системе.
Деление элементов на металлы и неметаллы является условным. Однако следует отметить, что металлические свойства возрастают с повышением массы атома и с ростом числа электронных оболочек. Согласно электронному строению (ls22s22p63s23p63d104s2) цинк является типичным металлом, находящимся в побочной подгруппе второй группы в системе элементов. Он имеет степень окисления +2, т.е. в химических соединениях является двухвалентным ионом. Это связано с тем, что для отрыва третьего электрона необходима большая энергия.
Постоянная валентность цинка, равная двум, как видно, обусловлена максимальной заполненностью d-слоя и высоким значением потенциала ионизации: Zn2+ - Zn3+ .
Согласно современным представлениям процесс ионизации металла протекает стадийно: скорости отрыва электрона на каждой стадии могут быть неодинаковыми. При растворении цинка в электролитах (например, при коррозии в водных растворах), если принять во внимание указанные выше величины энергии ионизации, можно ожидать образование сначала одновалентного иона цинка, затем двухвалентного. Экспериментально же удается определись только Zn2+. Показанные свойства, а также приводимые ниже физические свойства цинка позволяют отнести его к непереходным элементам.
Положением цинка в периодической системе элементов, определенным изначально по его атомной массе, равной 65, 37, обусловлен целый ряд присущих только ему свойств - физических и химических, о которых речь пойдет ниже. Здесь же лишь следует отметить, что наблюдаемые различия свойств иногда обусловлены участием в процессах изотопов цинка.
Таблица 1. Некоторые изотопы цинка
| Стабильные изотопы | Радиоактивные изотопы | |||||
| массовое число | содержание в природной смеси, % | массовое число | период полураспада, мин | массовое число | период полураспада, мин | |
| 64 | 48,89 | 60 | 2,1 | 67 | 1,4 ⋅ 10⁻⁷ | |
| 66 | 27,81 | 61 | 1,5 | 69 | 58 | |
| 67 | 4,11 | 62 | 558 | 71 | 2,2 | |
| 68 | 18,56 | 63 | 33,3 | 72 | 2940 | |
| 70 | 0,62 | 65 | 14700 | | | |
Следовательно, положение цинка в периодической системе, обусловленное его природой, позволяет прогнозировать свойства его соединений, а также взаимодействие с внешней средой.
Металлохимические свойства цинка
Цинк характеризуется наличием двух электронов в 4s внешней оболочке. Основное отличие цинка от металлов II группы заключается в том, что он имеет целиком заполненную десятью электронами 3d-oболочку (щелочноземельные металлы не имеют периферийных d-оболочек). Таким электронным строением цинка обусловливаются особенности его физико-химических и других свойств, а также отличие от металлов на группы.
В подгруппе цинка встречаются весьма оригинальные сочетания свойств переходных и непереходных элементов. С одной стороны, поскольку цинк не проявляет переменной валентности и не образует соединений с незаполненным d-слоем, его следует отнести к непереходным элементам. Об этом говорят и некоторые физические свойства цинка (низкая температура плавления и твердость, высокая электроположительность по сравнению с ближайшими "соседями" в переходных рядах). С другой стороны, цинк можно отнести и к переходным элементам, если учесть его склонность к реакциям комплексообразования. Диффузионный характер d-орбиталей делает цинк легко деформируемым.
Металлохимические свойства цинка, определяющие характер его взаимодействия с другими элементами, резко отличны от металлохимических свойств металлов щелочноземельной группы. На основании оценки разности значений атомных радиусов, потенциалов ионизации (рис. 1, б) и электроотрицательности (рис. 1, в) элементов периодической системы и цинка с учетом двойных диаграмм состояния (рис. 2) сделаны следующие выводы:
1. Цинк в обычных условиях является типичным электроотрицательным металлом и образует химические соединения со многими электроположительными металлами, за исключением тех, которые имеют близкие с цинком величины электроотрицательности. К числу последних следует отнести, например, Cd, Tl, Pb, In, Са, Ge.
2. Цинк в обычных условиях не образует непрерывных твердых растворов ни с одним элементом периодической системы.
3. Для цинка характерно образование ограниченных твердых растворов, например с Li, Mg, Cr, Mn, Fe, Co, Ni, Cu, Cd, Al, In, Tl, Sn, Pb. При этом растворимость цинка в электроположительных металлах (Li, Mg, Tl, Mn, Cd) значительно выше при соответствующих температурах, чем этих металлов в цинке.
4. Цинк в обычных условиях не взаимодействует с Mo, W, Re, В, С, Si, N. Пока отсутствуют сведения о взаимодействии цинка с Pb, Cs, Y, Nb, Та, Re, Os, Ru, Po, At.
Термодинамические свойства цинка
Широкое применение в технике получили цинк, сплавы и химические соединения на его основе. Для удовлетворения требований потребителей они должны иметь определенные свойства. Так, цинк и цинковые сплавы, как правило, должны быть устойчивы при воздействии среды. Получение же химических соединений основано на неустойчивости цинка в конкретных условиях, например в некоторых кислотах, щелочах, солях. Следовательно, в зависимости от постановки задачи цинк должен быть устойчивым или подвергаться изменениям. Принципиальный ответ на эти вопросы дает термодинамика.
В настоящее время накоплен обширный справочный материал, позволяющий без проведения специальных исследований определить возможности того или иного процесса. Поэтому прогноз применимости цинка для конкретных практических целей может быть сделан по данным о его термодинамических свойствах.
Под действием внутренних и внешних факторов цинк может переходить из одного состояния в другое. Такой переход в самом общем виде может быть выражен через энергию системы: GI = GII, где GI - энергия системы в исходном состоянии, например цинк, не изменяющийся в данных конкретных условиях; GII - энергия системы в новом состоянии, например химическое соединение цинка. Следовательно, мерой стабильности системы явлется изменение энергии, служащей движущей силой процесса: AG = GII - GI.
В настоящее время термодинамические законы изменения состояния систем достаточно глубоко изучены и описаны. В рамках настоящей книги следует лишь отметить, что для описания системы пользуются так называемыми термодинамическими потенциалами: внутренней энергией U = f(S, V, N, хi); энтальпией Н = f(S, Р, N, хi); энергией Гельмгольца А = f(V, Т, N, хi); энергией Гиббса G = f(Р, Т, N, хi), где S - энтропия; V - объем; Р - давление; Т-температура; хi -другие переменные параметры функции; N- число частиц системы.
Рассмотренные энергии определяются по простым уравнениям (табл. 2). Воспользовавшись указанными уравнениями и справочными данными о значении параметров, а также зная условия и режимы планируемого процесса, можно принципиально определить, возможен ли он, а в случае возможности - его направление.
Т а б л и ц а 2. Некоторые уравнения для расчета термодинамических параметров
| Параметры | Независимые переменные | Уравнения для расчета |
| Внутренняя энергия | V | 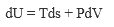 |
| | S | 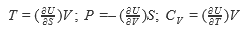 |
| Энтальпия | P | 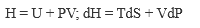 |
| | S | 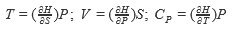 |
| Энергия Гельмгольца | V | 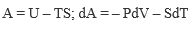 |
| | T | 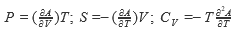 |
| Энергия Гиббса | P | 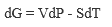 |
| | T | 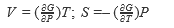 |
Для удобства пользования рассмотренными уравнениями в табл. 3-6 представлены численные значения параметров системы
Таблица 3. Термодинамические свойства цинка и его соединений
| Вещество | Ho298 - Ho0 Дж/моль | So298 Дж/(моль ⋅ К) | CoP298 Дж/(моль ⋅ К) | -ΔHof0 кДж/моль | -ΔHof298 кДж/моль | -ΔGof298 кДж/моль |
| Zn | 5665 | 25,46 | 29,40 | ‒ | ‒ | ‒ |
| ZnO | 6938 | 43,67 | 40,28 | 347,79 | 350,86 | 320,88 |
| ZnCl2 | 15064 | 111,54 | 71,38 | 415,54 | 415,33 | 369,64 |
| ZnS | 8918 | 57,78 | 45,55 | 204,41 | 205,60 | 200,85 |
| ZnCO3 | 13536 | 82,50 | 80,14 | 812,38 | 818,59 | 737,30 |
| ZnSO4 | 17237 | 110,62 | 99,14 | ‒ | 982,01 | 870,70 |
Таблица 4. Теплоемкости веществ, Дж/(моль ⋅ К) CP = a + bT + c’T⁻²
| Вещество | Состояние | a | b ⋅ 10⁻³ | c' ⋅ 10⁻⁵ | Температурный интервал, К |
| Zn | ж | 31,4 | ‒ | ‒ | 693‒1200 |
| | г | 20,8 | ‒ | ‒ | 298‒ 2000 |
| ZnO | к | 49 | 5,1 | 9,1 | 298‒ 1600 |
| ZnCl₂ | к | 60,7 | 23 | ‒ | 298‒591 |
| | ж | 100,9 | ‒ | ‒ | 591‒1005 |
| ZnS | к | 50,9 | 5,2 | 5,7 | 298‒1200 |
| ZnCO₃ | к | 38,9 | 138,2 | ‒ | 298‒500 |
| ZnSO₄ | к | 91,7 | 76,2 | ‒ | 298‒1100 |
Примечание: ж - жидкое, к - кристаллическое, г — газообразное.
Таблица 5. Изменение энергии Гиббса (Дж/моль) для некоторых реакций
∆G⁰T = A + CT; ∆GT = A + BTlgT + CT
| Реакция, фазовый переход | А | В | С | Ошибка ± кДж | ∆H, кДж/моль | ∆S, Дж/(моль⋅К) | Темпаратура или температурный интервал, К |
| Zn+1/2О₂=ZnО | 352 110 | 28,9 | 184,8 | 6,3 | ‒ | ‒ | 298‒693 |
| Zn+Cl₂=ZnCl₂ | 424 480 | 53,8 | 315,9 | 13 | ‒ | ‒ | 298‒586 |
| Zn+1/2S₂=ZnS | 266 490 | 19,3 | 153,57 | 17 | ‒ | ‒ | 298‒693 |
| Zn к → ж | ‒ | ‒ | ‒ | ‒ | 7,24 | 10,46 | 692,5 |
| Zn ж → г | ‒ | ‒ | ‒ | ‒ | 115,39 | 97,85 | 1179,35 |
Таблица 6. Термодинамические свойства неорганических веществ в водном растворе S⁰₂₉₈
| Ион, молекула | -ΔHof298 кДж/моль | -ΔGof298 кДж/моль | So298 Дж/(моль ⋅ К) |
| Zn²⁺ | 153,74 | 147,26 | ‒110,67 ± 5,0 |
| ZnCl₂ | 488,18 | 409,97 | 2,45 ± 5,0 |
| ZnS | 121,08 | 61,81 | ‒125,20 ± 12,6 |
| ZnCO₃ | 830,83 | 675,22 | ‒166,76 ± 6,7 |
| ZnSO₄ | 1065,3 | 893,41 | ‒96,67 ± 5,0 |
Как видно, на основании их сопоставления, а также расчета свойств для конкретных температурных режимов можно оценить предпочтительность процессов, их возможность или невозможность.
В вышеприведенных таблицах: С0p298 = 36,8 Дж/ (моль • К); СР - теплоемкость при постоянном давлении; ΔG°f298 - энергия Гиббса при 298,15 К; ΔН°f0 и ΔH°f298 - энтальпия образования соединений при 0 и 298,15 К соответственно: S0298 - стандартная энтропия при 298,15 К.
5. Электрохимические и химические свойства
Большинство природных сред, растворы кислот, щелочей и солей являются электролитами. Поэтому поведение в них цинка (прежде всего коррозия) определяется его электрохимическими свойствами. Особенностью электрохимических реакций является то, что они протекают при участии свободных электронов и в основном при пространственном разделении процессов окисления и восстановления (сопряженных реакций). Примером может служить реакция коррозии цинка в водном растворе: Zn + 2Н2О → Zn(OH)2 + Н2, где Zn - 2e→Zn2+, 2Н+ + 2е→Н2. На электрохимических реакциях основаны процессы нанесения гальванических и химических цинковых покрытий, а также растворения цинка при анодной поляризации.
Из рассмотренных явлений термодинамики очевидно, что любой процесс может протекать самопроизвольно только при ΔG < 0. Для окислительно-восстановительных процессов, протекающих при погружении металла в электролит, изменение энергии Гиббса определяется из выражения: ΔG = -nφF, где п - число электронов, участвующих в реакции; φ - потенциал электродного процесса, определяемый по уравнению Нернста.
Для характеристики металлов, сравнительной оценки возможности электродного процесса и опасности контактов между металлами часто пользуются так называемым рядом напряжения: Li-К-Ва-Са-Na-La-Nd-Mg-А1-Ti-Zr-Mn-V-Nb-Se-Сг-Те-Zn-Ga-Fe-Cd-Co-Ni-Mo-In-Sn-Pb-Ge-H2 (φ0= 0)-Bi-Cu-Hg-Ag-Pt-О2 (φ0 = 1.228) - Au.
От лития до золота активность металла снижается и повышается коррозионная стойкость. Следовательно, при контакте двух металлов коррозии будет подвержен расположенный слева, причем чем дальше один от другого отстоят металлы, тем опаснее их контакт (сильнее контактная коррозия). Это объясняется тем, что возрастает разность потенциалов и, следовательно, -ΔG, являющаяся движущей силой процесса.
В рассмотренных уравнениях переменным параметром является только потенциал электродного процесса, причем φo для основных электродных реакций является справочной величиной. Таким образом, без проведения каких-либо экспериментов, воспользовавшись ею, можно определить ΔG0, т.е. возможность электродного процесса.
Окислительно-восстановительные реакции цинка в электролитах, как правило, идут с участием двух электронов. Его стандартный потенциал равен - 0,763 В; с повышением температуры от 298 до 473 К он повышается до -0,750 В. В этих условиях энергия Гиббса (ΔGfT) уменьшается от 147 до 145 кДж/моль. Очевидно, склонность цинка к ионизации по мере увеличения потенциала снижается.
В конкретных условиях можно определить L и рассчитать величину φ.
Наиболее полно связь потенциала с рН воды и возможный механизм процесса растворения цинка устанавливаются по диаграмме, показанной на рис. 3.
Как видно на рисунке, потенциал цинка зависит от величины рН и активности ионов, причем в определенных условиях наблюдается равновесие между жидкой и твердой фазами. В целом состояние системы в наиболее характерных точках диаграммы описывается уравнениями, приведенными в табл. 7.
Из представленных выше данных можно судить о механизме окислительно-восстановительных процессов при погружении цинка в воду.
Для оценки сравнительной активности цинка в водных растворах представляют интерес стандартные потенциалы электродных процессов, представленных ниже, В:
| Zn = Zn²⁺ + 2e | ‒0,763 |
| Zn + 2H₂O = Zn(OH)₂ (орторомб) + 2H⁺ + 2e | ‒0,439 |
| Zn + 2H₂O = Zn(OH)₂ (аморфн.) + 2H⁺ + 2e | ‒0,400 |
| Zn + 2H₂O = HZnO⁻₂ + 3H⁺ + 2e | 0,054 |
| Zn + 2H₂O = HZnO⁻₂ + 4H⁺ + 2e | 0,441 |
| Zn + S² = ZnS + 2e | ‒1,44 |
| Zn + 4CN = ⟦Zn(CN)₄⟧²⁺ + 2e | ‒1,26 |
| Zn + CO²⁻₃ = ZnCO₃ + 2e | ‒1,06 |
| Zn + 4NH₃ (водн) = ⟦Zn(NH₃ )₄ ⟧²⁺ + 2e | ‒1,04 |
Таблица 7 Основные процессы, определяющие термодинамическое состояние цинка и его оксидов в воде
| Номера прямых на рис. 3 | Электродный процесс | Условия равновесия системы |
| а | H₂ = 2H⁺ + 2e | 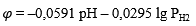 |
| б | 2H₂O = O₂ + 4H⁺ + 4e | 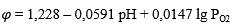 |
| ‒ | Zn²⁺ + H₂O = ZnOH⁺ + H⁺ | 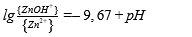 |
| ‒ | ZnOH⁺ + H₂O = HZnO⁻₂ + 2H⁺ | 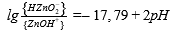 |
| ‒ | Zn²⁺ + 2H₂O = HZnO⁻₂ + 3H⁺ | 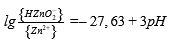 |
| ‒ | HZnO⁻₂ = ZnO²⁻₂ + H⁺ | 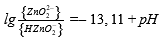 |
| ‒ | Zn²⁺ / ZnOH⁺ | pH = 9,67 |
| ‒ | ZnOH⁺ / HZnO⁻₂ | pH = 8,98 |
| 3I | Zn²⁺ / HZnO⁻₂ | pH = 9,21 |
| 4I | HZnO⁻₂ / ZnO²⁻₂ | pH = 13,11 |
| 5 | Zn + 2H₂O = Zn(OH)₂ (аморфн.) + 2H⁺ + 2e | 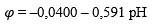 |
| 6 | Zn²⁺ + 2H₂O = Zn(OH)₂ (аморфн.) + 2H⁺ | 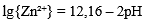 |
| 7 | Zn(OH)₂ (аморфн.) = HZnO⁻₂ + H⁺ | 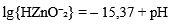 |
| 8 | Zn(OH)₂ (аморфн.) = ZnO²⁻₂ + 2H⁺ | 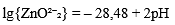 |
| 9 | Zn = Zn²⁺ + 2e | 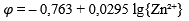 |
| 10 | Zn + 2H₂O = HZnO⁻₂ + 3H⁺ + 2e | 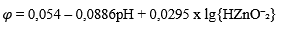 |
| 11 | Zn + 2H₂O = ZnO²⁻₂ + 4H⁺ + 2e | 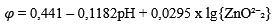 |
Приведенные выше данные раскрывают только принципиальную возможность процесса, не говоря о ее кинетике - скорости. Следует отметить, что если термодинамически установлена невозможность процесса, то и практически он не будет совершаться. Однако, если возможность процесса и установлена термодинамически, он также может не идти или протекать с неодинаковой скоростью, величина которой, как правило, определяется экспериментально. Различие теоретически определенных и практически наблюдаемых скоростей электродного процесса обусловлено перенапряжением n - "сопротивлением" реакции. Под перенапряжением понимается сдвиг потенциала от стандартного при поляризации металла, необходимый для протекания данной конкретной электродной реакции, определяемый по формуле Тафеля: n= а + b 1 g i , где а и b - постоянные коэффициенты; i - плотность тока поляризации.
Экспериментально указанная зависимость определяется очень просто - путем снятия поляризационных кривых (рис. 4). Как видно, при i = 1 А/см2 n =а, т.е. характеризует необратимость электродного процесса. Величина b (тангенс угла наклона кривой) характеризует скорость процесса. Для некоторых характерных случаев, например для выделения водорода на цинке в водных растворах кислот и щелочей, значения коэффициентов а и b уравнения Тафеля представлены ниже: для 1 н. H2SО4 а = 1,246В; b = 0,116 В; для 6 н. NaOH а = 1,23 В; b = 0,22 В.
Следовательно, задавая плотность тока поляризации, можно определить перенапряжение электродного процесса. Это в свою очередь позволяет выбрать режимы поляризации для осуществления процесса.
Возможность химической реакции определяется величиной энергии Гиббса для образования соединений.
Для большинства наиболее важных веществ известны и являются справочными величины изменения энергии Гиббса и константы равновесия при стандартных условиях (T = 298,15 К). Это позволяет принципиально оценивать возможность реакции образования химического соединения между любыми простыми веществами.
Под химическими свойствами цинка, как и любого другого металла, понимаются его способности взаимодействовать с другими веществами путем обмена электронами, т.е. без участия свободных электронов. При этом продуктом химической реакции является соединение из взаимодействующих веществ, например 2Zn +O2 → 2ZnO.
Рассмотренные выше способности, определяющие химические свойства металлов (цинка), проявляются и при их взаимодействии с неэлектролитами (сухими газами и органическими веществами).
При комнатной температуре цинк практически не взаимодействует с большинством газообразных веществ. Только при сильном нагревании он начинает взаимодействовать с кислородом воздуха, газообразным хлором, бромом, иодом, фтором и многими другими газами. Цинк не взаимодействует с азотом, водородом, углеродом. При нагревании с серой и фосфором реагирует со взрывом.
Рассмотренные выше обобщенные сведения об электрохимических и химических свойствах цинка позволяют констатировать их многообразие и зависимость как от физической природы металла, так и от внешних факторов. Знание особенности поведения цинка в конкретных условиях, основанных на приведенных общих представлениях, имеет практический интерес.
Механические и технологические свойства цинка
Механические свойства цинка, особенно временное сопротивление (σв), удлинение (δ,%) и твердость (НВ), существенно зависят от состояния обработки цинка. По данным различных работ, цинк в литом состоянии имеет следующие механические свойства: σв = 30-80 МПа, δ = 0,3-4,0 %, НВ = 200-500 МПа.
При комнатной температуре цинк в литом состоянии имеет ограниченную пластичность и плохо прокатывается, так как деформация происходит только по базисной плоскости (001), т.е. параллельно направлению роста кристаллов. В связи с этим наступает резкая анизотропность свойств деформированного цинка. При этом цинк значительно прочнее поперек направления прокатки, чем вдоль нее.
Цинк в деформированном состоянии характеризуется следующими механическими свойствами: σв = 140-250 МПа; δ = 15-50 %; НВ = 330-500 МПа.
Прочностные свойства цинка сильно зависят от температуры.
При температуре ниже 0°С наблюдается охрупчивание цинка, а при повышении температуры происходит возрастание пластичности. Так, при 100-150 °С цинк становится настолько пластичным, что из него можно прокатывать листы толщиной в сотые доли миллиметра. Показатели пластичности литого и деформированного цинка при одинаковой температуре различны. Максимальное значение относительного удлинения деформированного цинка наблюдается при 150 °С, а для литого - в пределах 200-300 °С в зависимости от содержания примесей (рис. 5).
Хотя цинк и обладает высокой пластичностью при прокатке в широком интервале температур, горячую прокатку электролитного цинка (марки Ц0) следует проводить при 150-200 °С, а полиграфического цинка (марка ЦЗ) - при 180-220 °С. Чистейший цинк хорошо куется и прокатывается в интервале температур 150-200 °С. С повышением температуры происходит снижение твердости литого цинка (рис. 6).
Примеси оказывают заметное влияние на механические свойства цинка. Данные о влиянии основных примесных элементов на твердость и ударную вязкость цинка приведены в табл. 8. Исходный цинк содержал 0,019% Cd, 0,014% Pb, 0,001% Сu; содержание остальных контролируемых примесей находилось в пределах 0,001-0,008 %. Действие примесей изучали в интервале от 0,1 до 3,0 %.
Из табл. 8 следует, что наиболее сильное влияние на твердость цинка в сторону повышения оказывает магний и несколько меньшее- медь и железо. Сурьма и кадмий в пределах до 1 % слегка повышают твердость цинка, но с увеличением содержания этих элементов в цинке свыше 1 % твердость цинка практически не изменяется. Свинец и особенно олово в рассмотренных пределах практически не оказывают влияния на твердость исходного цинка.
Таблица 8. Механические свойства цинка различной чистоты [ по Волу А.Е.]
| Содержание примесей, % | Pb | Fe | Cd | Sn | Cu | Mg | Sb |
| Твердость, МПа | |||||||
| Исходный цинк | 420 | 420 | 420 | 420 | 420 | 420 | 420 |
| 0,1 | 370 | 480 | ‒ | 440 | 460 | 510 | 450 |
| 0,5 | 385 | 515 | 500 | 430 | 575 | 630 | 470 |
| 1,0 | 375 | 570 | 530 | 400 | 630 | 750 | 500 |
| 2,0 | 370 | 625 | 540 | 400 | 705 | 930 | 510 |
| 3,0 | 370 | 670 | 530 | 350 | 730 | 1390 | 540 |
| Ударная вязкость, Дж/см² | |||||||
| Исходный цинк | 3,5 | 3,5 | 3,5 | 3,5 | 3,5 | 3,5 | 3,5 |
| 0,1 | 3,5 | 2,9 | ‒ | 3,0 | 3,5 | 3,1 | 3,4 |
| 0,5 | 3,5 | 2,4 | 3,3 | 3,0 | 3,6 | 2,3 | 3,0 |
| 1,0 | 4,0 | 1,9 | 3,2 | 3,1 | 4,0 | 2,1 | 2,9 |
| 2,0 | 3,5 | 1,7 | 3,2 | 3,7 | 4,5 | 1,9 | 2,6 |
| 3,0 | 3,3 | 1,6 | 3,3 | 4,0 | 4,8 | 1,1 | 2,6 |
Наибольшее влияние на величину ударной вязкости цинка оказывают железо и магний, а также сурьма, незначительные содержания которых сильно понижают ее значения. Медь повышает величину ударной вязкости цинка, а олово, понижая ее вначале, при содержании 3 % дает заметное повышение. Кадмий и свинец не оказывают заметного влияния на величину ударной вязкости цинка.
Структура цинка также оказывает влияние на механические свойства литого металла. Механические свойства литого цинка, содержащего 1,12 % Рb, 0,11 % Cd, 0,03 % Fe и 0,002 % Сu, приведены ниже:
σв = 74/27; δ = 1,6/0,1; ан=3300/2300; HB = 470/440
Твердость цинка изменяется от 200 до 500 МПа для крупнозернистой и мелкозернистой структуры соответственно. Для столбчатой структуры литого цинка характерна анизотропия свойств. Изучение анизотропии литого цинка на образцах, вырезанных параллельно и перпендикулярно к направлению роста столбчатых кристаллов, показало следующее: временное сопротивление равнялось 540 и 160 МПа, а относительное удлинение 4,5 и 1,5% соответственно. Поэтому наиболее благоприятным условием для пластической деформации литого цинка будет совпадение направления деформирующего усилия с осью столбчатых кристаллов.
В процессе горячей прокатки пластичность цинка после первых проходов возрастает благодаря переходу литой структуры в деформированную. При этом происходит рост числа кристаллов, благоприятно ориентированных для деформации.
Для превращения литой структуры электролитного цинка высокой чистоты в деформированную с полной рекристаллизацией достаточно суммарного обжатия в 30-50 % в зависимости от температуры прокатки, причем превращение характерной крупнокристаллической столбчатой структуры литого цинка в деформированную мелкозернистую происходит быстрее с повышением температуры.
Из технологических свойств цинка особо следует отметить поверхностное натяжение, смачиваемость, вязкость, жидкотекучесть, усадку.
Влияние отдельных элементов на некоторые технологические свойства цинка приведено в табл. 9.
Цинк имеет хорошую жидкотекучесть, что обеспечивает хорошую заполняемость литейных форм.
Таблица 9. Свойства цинковых сплавов, содержащих различные элементы
| Элемент | Жидкотекучесть | Усадка | Стойкость форм | Прочность при высоких температурах | Механическая обрабатываемость | Полируемость |
| Cu | + | ‒ | ‒ | + | от + до ‒ * | + |
| Si | + | ‒ | + | + | то же | ‒ |
| Fe | ‒ | от + до ‒ * | ‒ | + | “ | + |
| Ni | ‒ | то же | ‒ | + | “ | + |
| Zn | + | + | 0 | ‒ | + | ‒ |
| Mn | ‒ | ‒ | ‒ | + | от + до ‒ * | + |
| Mg | ‒ | + | 0 | ‒ | ‒ | ‒ |
| Sn | + | + | ‒ | ‒ | + | ‒ |
Примечание. + улучшение свойств; ‒ ухудшение свойств. * В зависимости от концентрации элемента.
Переплавка цинка, как правило, ухудшает жидкотекучесть вследствие обогащения расплава оксидами. Поверхностное натяжение цинка также оказывает влияние на заполняемость литейной формы. Заполнение особо тонких элементов отливок (толщиной до 3-5 мм) связано с преодолением поверхностного натяжения металла, которое у цинка с повышением температуры понижается и при критической температуре становится равным нулю. Зависимость поверхностного натяжения и плотности цинка от температуры (по данным Беняковского М.А.) выражается следующими соотношениями: о = 754-0,090 (t-419), у= 6,59-0,00097(t-419), где t, °с.
Значительное влияние на величину поверхностного натяжения цинка оказывают примеси, поэтому при введении в расплав малых добавок некоторых элементов можно улучшить технологические свойства цинка. Это должны быть элементы, понижающие поверхностное натяжение на границе раздела жидкость-газ или двух жидкостей: поверхностно-активные элементы. По отношению к расплавленн
| Краткие обозначения: | ||||
| σв | - временное сопротивление разрыву (предел прочности при растяжении), МПа | ε | - относительная осадка при появлении первой трещины, % | |
| σ0,05 | - предел упругости, МПа | Jк | - предел прочности при кручении, максимальное касательное напряжение, МПа | |
| σ0,2 | - предел текучести условный, МПа | σизг | - предел прочности при изгибе, МПа | |
| δ5,δ4,δ10 | - относительное удлинение после разрыва, % | σ-1 | - предел выносливости при испытании на изгиб с симметричным циклом нагружения, МПа | |
| σсж0,05 и σсж | - предел текучести при сжатии, МПа | J-1 | - предел выносливости при испытание на кручение с симметричным циклом нагружения, МПа | |
| ν | - относительный сдвиг, % | n | - количество циклов нагружения | |
| sв | - предел кратковременной прочности, МПа | R и ρ | - удельное электросопротивление, Ом·м | |
| ψ | - относительное сужение, % | E | - модуль упругости нормальный, ГПа | |
| KCU и KCV | - ударная вязкость, определенная на образце с концентраторами соответственно вида U и V, Дж/см2 | T | - температура, при которой получены свойства, Град | |
| sT | - предел пропорциональности (предел текучести для остаточной деформации), МПа | l и λ | - коэффициент теплопроводности (теплоемкость материала), Вт/(м·°С) | |
| HB | - твердость по Бринеллю | C | - удельная теплоемкость материала (диапазон 20o - T ), [Дж/(кг·град)] | |
| HV | - твердость по Виккерсу | pn и r | - плотность кг/м3 | |
| HRCэ | - твердость по Роквеллу, шкала С | а | - коэффициент температурного (линейного) расширения (диапазон 20o - T ), 1/°С | |
| HRB | - твердость по Роквеллу, шкала В | σtТ | - предел длительной прочности, МПа | |
| HSD | - твердость по Шору | G | - модуль упругости при сдвиге кручением, ГПа | |

